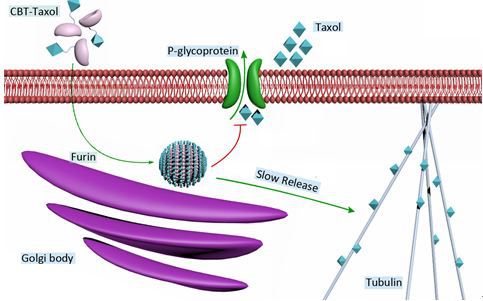
肿瘤的多药耐药(MDR)性是导致癌症化疗失败的重要原因之一,也是临床癌症治疗的最大挑战。MDR现象源于具有能量依赖性“药泵”功能的细胞膜蛋白的表达增多,导致药物在到达胞内靶点前即被拦截或泵出。因此开发出更多更好的抗多药耐药性策略非常重要。与常见的通过抑制MDR外排泵作用或利用纳米载体负载大量药物的方法不同,梁高林教授课题组设计了一种可在癌细胞内“智能”自组装成纳米药物的策略,其同时兼具靶向富集和药物缓释的策略为抗MDR的发展提供了新思路。设计的“智能”小分子药物为Ac-Arg-Val-Arg-Arg-Cys(StBu)-Lys(taxol)-CBT(CBT-Taxol)。当CBT-Taxol进入Furin酶高表达的癌细胞后,Cys上双硫键被细胞内大量的GSH还原,Ac-Arg-Val-Arg-Arg被Furin剪切脱离,裸露的Cys与CBT缩合形成环状二聚体,再通过自组装生成紫杉醇(taxol)的纳米粒子(Taxol-NPs)并富集在癌细胞中。纳米药物在癌细胞内酯酶作用下缓慢解组装释放出游离的紫杉醇从而杀死癌细胞。与张华凤教授课题组合作的细胞及小鼠活体实验表明,与taxol相比,CBT-Taxol的抗耐药指数分别提高了4.5倍及1.5倍,并且没有对模型鼠产生毒性。这种新型的抗MDR策略将为药物设计及癌症治疗提供新的思路,也将会在癌症的临床治疗上有着极大的应用前景。
该论文共同第一作者为中国科学技术大学化学与材料科学学院博士生袁月和生命科学学院博士生王林。
该项目研究得到苏州纳米科技协同创新中心、合肥物质科学技术中心重要项目培育基金、国家自然科学基金(21175122, 21375121, 31171358和31371429)、国家重点基础研究发展计划(2014CB910604)和安徽省自然科学基金(1508085JGD06)的资助。